Nomenclatura dos compostos inorgânicos
27/01/2020
Funções inorgânicas
BASES
São compostos constituídos por um metal (que não faz parte do grupo do FONClBrSICPH) associado à uma hidroxila.
Nomenclatura
Os metais da familia 1, 2 e Al, possuem nox fixo, 1+, 2+ e 3+ respectivamente. A nomenclatura gral das bases é : hidróxido de (nome do metal).
Exemplos :
NaOH – Hidróxido de sódio
Ca(OH)2 – Hidróxido de cálcio
Alguns metais de transição (familia B) possuem nox diferentes. Convém saber os principais:
Ferro (Fe) — 2+ e 3+
Cobre (Cu) — 1+ e 2+
Chumbo (Pb) — 2+ e 4+
Estanho (Sn) — 2+ e 4+
Para esses casos a nomenclatura utilizada é : hidróxido de + (nome do metal) + (nox, em algarismos romanos).
Exemplos :
CuOH — hidróxido de cobre I
Cu(OH)2 — hidróxido de cobre II
Fe(OH)2 — hidróxido de ferro II
Fe(OH)3 — hidróxido de ferro Ill
Para os demais metais de transição que possuam apenas um único nox, a nomenclatura é a mesma das famílias 1, 2 e Al. É bom memorizar o nox de alguns elementos de transição:
Prata (Ag) — +1
Zinco (Zn) — +2
ÁCIDOS
São compostos constituídos por H+ e ânions (FONClBrSICPH).
a) Nomenclatura
Para efeito de nomenclatura, os ácidos são divididos em hidrácidos e oxiácidos.
a1) Hidrácidos
São ácidos que não possuem oxigênio(s) em sua formulação. Seus nomes são terminados em ídrico.
Exemplo:
HBr – Ácido bromídrico
H2S – Ácido sulfídrico
HCN – Ácido cianídrico
a2) Oxiácidos
São ácidos que possuem oxigênio em sua formulação. Seus nomes são terminados em ico ou oso. A maneira mais fácil de dar nome a esses ácidos é a partir do nome e da fórmula dos ácidos padrão, listados a seguir:
HClO3 – Ácido clórico H3PO4 – Ácido fosfórico
H2SO4 – Ácido sulfúrico H2CO3–Ácido carbônico
HNO3 – Ácido nítrico H3BO3 – Ácido bórico
A partir dessas fórmulas e de acordo com o número de átomos de oxigênio, determinam-se as fórmulas e os nomes de outros ácidos, com o uso de prefixos e sufixos.Desse modo teremos:
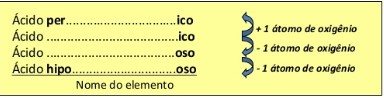
HClO4 – ácido perclórico H3PO4 – ácido fosfórico
HClO3 – ácido clórico H3PO3 – ácido fosforoso
HClO2 – ácido cloroso H3PO2–ácido hipofosforoso
HClO – ácido hipocloroso H3PO2–ácido hipofosforoso
H2SO4 – ácido sulfúrico H2SO3 – ácido sulfuroso
SAIS
São compostos constituídos por um cátion, proveniente de uma base, e um ânion, proveniente de um ácido. Basicamente, a nomenclatura dos sais é realizada escrevendo-se o nome do ânion que veio do ácido, trocando-se a sua terminação, conforme mostrado abaixo, terminando com o nome do cátion que veio da base.
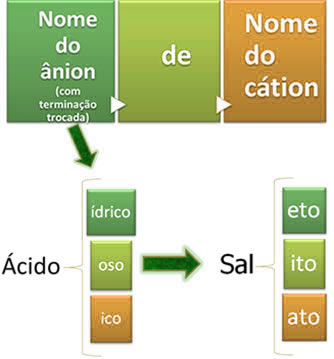
Veja alguns exemplos:

ÓXIDOS
São compostos binários onde o último elemento é o oxigênio. Existem alguns tipos de óxidos: Óxido básico, óxido anfótero, óxido ácido ou anidrido, peróxido, óxido neutro ou indiferente
- Óxido básico – São óxidos que, em presença de água, formam as respectivas bases, ou seja, apresentam caráter básico. O elemento que compõe esse tipo de óxido são os metais (os que não fazem parte do FONClBrSICPH). Cuidado com os metais que apresentam mais de uma carga (Nox) diferente. Há necessidade de identificá-los.
Exemplos:
Na2O – Óxido de sódio
MgO – Óxido de magnésio
FeO – Óxido de ferro II
Fe2O3 – Óxido de ferro III
Cu2O – Óxido de cobre I
CuO – Óxido de cobre II
- Óxido ácido ou anidrido – São óxidos que, em presença de água, formam os respectivos ácidos, ou seja, apresentam caráter ácido. O elemento que compõe esse tipo de óxido são os ametais (os que fazem parte do FONClBrSICPH).
Exemplos:
CO2 – Dióxido de carbono
B2O3 – Trióxido de diboro
N2O3 – Trióxido de dinitrogênio
N2O5 – Pentóxido de dinitrogênio
SO2 – Dióxido de enxofre
SO3 – Trióxido de enxofre
P2O3 – Trióxido de difósforo
P2O5 – Pentóxido de difósforo
- Óxido Neutro – não reagem nem com a água, nem com os ácidos e nem com as bases, são eles :
CO – monóxido de carbono
NO – Óxido nitroso
N2O – Óxido nítrico
- Peróxido – São óxidos que reagem com a água ou com ácidos diluídos produzindo água oxigenada (H2O2). Nesses compostos há a presença da família 1 (alcalinos) ou 2 (alcalinos terrosos) junto com o O22¯ .
H2O2 – Peróxido de hidrogênio
Li2O2 – Peróxido de lítio
Na2O2 – Peróxido de sódio
K2O2 – Peróxido de potássio
Rb2O2 – Peróxido de rubídio
Cs2O2 – Peróxido de césio
BeO2 – Peróxido de berílio
MgO2 – Peróxido de magnésio
CaO2 – Peróxido de cálcio
SrO2 – Peróxido de estrôncio
BaO2 – Peróxido de bário
Compostos importantes e seus nomes usuais e oficiais
NaOH → Soda cáustica – Hidróxido de sódio
HCl → Ácido muriático – é o ácido clorídrico com impurezas – Cloreto de hidrogênio ou ácido clorídrico – Utilizado em limpeza doméstica e de peças metálicas.
NaCl → Sal de cozinha – Cloreto de sódio
NaClO → Cândida – Hipoclorito de sódio
CaO → Cal viva ou cal virgem – Óxido de cálcio
Ca(OH)2 → Cal apagada ou cal extinta – Hidróxido de cálcio
CH4 → Gás metano
CO2 → Gás carbônico – Dióxido de carbono
CO → Gás monóxido de carbono – Monóxido de carbono
NH4OH → Hidróxido de amônio
Mg(OH)2 → Leite de magnésia – Hidróxido de magnésio – Utilizado para combater a acidez estomacal.
CaCO3 → Mármore – Carbonato de cálcio
CaSO4 → Gesso – Sulfato de cálcio
NH3 → Amoníaco ou gás amônia
Ba(OH)2 → Água de barita – suspensão de Ba(OH)2 em água. – Hidróxido de bário
H2O2 → Água oxigenada – Peróxido de hidrogênio
NaHCO3 → Bicarbonato de sódio – Carbonato ácido de sódio

